A eletrólise encontra grande utilidade na indústria química, como na produção de metais como o alumínio, o cloro, magnésio, potássio, etc. Por meio dela é possível isolar algumas substâncias fundamentais para muitos meios de produção, como o hidróxido de sódio (soda cáustica) e peróxido de hidrogênio (água oxigenada), além da deposição de finas películas de metais sobre peças metálicas ou plásticas, numa técnica conhecida como galvanização. Além disso, é um processo que purifica e protege (como revestimento) vários metais.
Conceito: é a reação de oxi-redução provocada pela corrente elétrica.
Eletrólise do grego elektron "eletricidade" e lysis "decomposição".
Algumas reações químicas acontecem apenas quando fornecemos energia na forma de eletricidade, enquanto outras geram eletricidade no momento em que ocorrem. A eletrólise trata de um processo químico inverso ao da pilha (que é espontâneo e transforma energia química em elétrica).
O processo eletrolítico se dá a partir do fornecimento de energia vindo de uma pilha, que serve de gerador. Com isso, ocorre a descarga de íons, onde ocorre uma perda de carga por parte de cátions e ânions. Consequentemente, os cátions irão receber elétrons, sofrendo redução, enquanto que os ânions irão ceder elétrons, sofrendo oxidação. Tais reações ocorrem entre dois ou mais eletrodos mergulhados em uma solução condutora, onde será estabelecida uma diferença de potencial elétrico.
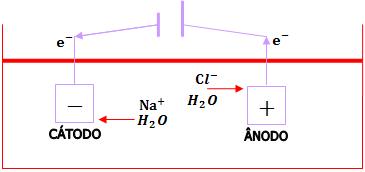
As formas comuns de eletrólise são a eletrólise ígnea e a eletrólise aquosa: na eletrólise ígnea, não há presença de água, e a passagem da corrente elétrica acontece em uma substância iônica no estado de fusão (liquefeita ou fundida). É um tipo de reação muito utilizado na indústria, principalmente para a produção de metais, como por exemplo o alumínio a partir da bauxita (minério de alumínio). Já a eletrólise aquosa se dá com a passagem elétrica através de um líquido condutor. Neste tipo, apenas um dos cátions e um dos ânions são participantes. É na eletrólise do cloreto de sódio em meio aquoso que são produzidos a soda cáustica (NaOH), o gás hidrogênio (H2) e o gás cloro (Cl2).
Eletrólise de solução aquosa de NaCl, com eletrodos inertes.

LEMBRE-SE
Pilha e eletrólise são processos contrários, os sinais do ânodo
e cátodo são também invertidos.
ÂNODO
Pilha: fornece elétrons , sinal negativo
Eletrólise : recebe elétrons dos ânions do eletrólito e tem
sinal positivo.
CÁTODO
Pilha: recebe elétrons e tem sinal positivo
Eletrólise : fornece elétrons dos cátions do eletrólito e tem
sinal negativo
ÂNODO
Tanto na pilha como na
eletrólise é o local onde ocorre oxidação
CÁTODO
Tanto a pilha como na
eletrólise é o local onde corre redução.
ELETRÓLISE ÍGNEA
É o processo de decomposição de uma substância iônica fundida
por meio da passagem de corrente elétrica.
A eletrólise
do cloreto de sódio fundido
( um exemplo de eletrólise ígnea )
( um exemplo de eletrólise ígnea )

Ela consiste em um par de eletrodos inertes, digamos, de
platina, mergulhados no NaCl fundido (líquido).
Como o ponto de fusão do NaCl é cerca de 800oC, a
célula deve operar acima desta temperatura.
A bateria ligada por meio do circuito externo tem a finalidade
de bombear elétrons para fora do ânodo e para dentro do cátodo
Os íons de cloro com a sua carga negativa são atraídos ao ânodo,
onde perdem um elétron:
Cl -  Cl +
e-
Cl +
e-
 Cl +
e-
Cl +
e-
os átomos de cloro se juntam, dois a dois, formando gás
Cl2:
2 Cl -  Cl2 (g)
Cl2 (g)
 Cl2 (g)
Cl2 (g)
a reação anódica é:
2 Cl -  Cl2 (g) + 2 e -
Cl2 (g) + 2 e -
 Cl2 (g) + 2 e -
Cl2 (g) + 2 e -
Os íons de sódio positivamente carregados são atraídos para o
cátodo, onde cada íon recebe um elétron:
Na+ + e -  Na(l)
Na(l)
 Na(l)
Na(l)
Sendo o ponto de fusão do sódio apenas 98oC, o sódio
que se forma permanece líquido e sobe à superfície nas proximidades do
eletrodo.
A reação da célula eletrolítica será:
Ânodo: 2 Cl - 

Cl2(g) + 2 e -
(oxidação)
Cátodo: { Na+ + e-  Na(l) } x 2
Na(l) } x 2
 Na(l) } x 2
Na(l) } x 2
(redução)
2 Na + + 2 Cl-  2 Na(l) + Cl 2 (g)
2 Na(l) + Cl 2 (g)
 2 Na(l) + Cl 2 (g)
2 Na(l) + Cl 2 (g)
À medida que os íons Cl- são removidos no ânodo,
outros íons Cl- se movem em direção a este eletrodo e tomam lugar dos
primeiros. Semelhantemente, a remoção dos íons Na+ no cátodo acarreta
a movimentação de outros Na+ para esse eletrodo.
Nenhum comentário:
Postar um comentário
DEIXE SEU COMENTÁRIO SOBRE O QUE ACHOU DESTE BLOG